हैलोजन: भौतिक गुण, रासायनिक गुण है । के उपयोग हैलोजन और उनके यौगिकों
हैलोजन में आवर्त सारणी के बाईं ओर स्थित नोबल गैसों. इन पांच विषैले, गैर धातु तत्वों के समूह में हैं, 7 की आवर्त सारणी. इन में शामिल हैं, फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और astatine. हालांकि astatine रेडियोधर्मी है और केवल अल्पकालिक आइसोटोप, यह की तरह बर्ताव करता है आयोडीन, और यह है अक्सर संदर्भित करने के लिए हैलोजन । क्योंकि हैलोजन तत्वों सात valence इलेक्ट्रॉनों, वे की जरूरत है केवल एक अतिरिक्त इलेक्ट्रॉन के लिए फार्म एक पूरा octet में है । इस सुविधा बनाता है उन्हें और अधिक सक्रिय तुलना में अन्य समूहों की गैर-धातु.
सामान्य विशेषताओं
हैलोजन रूप द्विपरमाणुक अणुओं (के रूप X2, जहाँ X एक हलोजन) – सतत फार्म के अस्तित्व के Halogens के रूप में नि: शुल्क तत्वों. संबंधों के इन द्विपरमाणुक अणुओं कर रहे हैं गैर-ध्रुवीय सहसंयोजक और एकल । रासायनिक गुणों के Halogens करने के लिए उन्हें अनुमति देता है आसानी से में प्रवेश के साथ एक बांड का सबसे तत्वों, तो वे कभी नहीं से मिलने में अनबाउंड के रूप में प्रकृति. फ्लोराइड – सबसे अधिक सक्रिय हलोजन और astatine – कम से कम है.
के सभी हैलोजन लवण फार्म के समूह मैं के साथ इसी तरह के गुण है । इन यौगिकों में, हैलोजन के रूप में मौजूद हैं halide anions के एक आरोप के साथ -1 (जैसे Cl-, Br-). अंत में आईडी की उपस्थिति इंगित करता है halide anions; उदाहरण के लिए, Cl- कहा जाता है "क्लोराइड".
इसके अलावा, रासायनिक गुणों के Halogens करने के लिए उन्हें अनुमति देता है के रूप में कार्य ऑक्सीकरण एजेंट – करने के लिए oxidize धातुओं. सबसे रासायनिक प्रतिक्रियाओं को शामिल हैलोजन और ndash; ऑक्सीकरण में कमी जलीय समाधान है । हैलोजन फार्म एकल के साथ बांड कार्बन या नाइट्रोजन कार्बनिक यौगिकों में, जहां ऑक्सीकरण की डिग्री (CO) -1. जब एक परमाणु के हलोजन प्रतिस्थापित covalently बाध्य हाइड्रोजन एटम में एक कार्बनिक यौगिक है, उपसर्ग हेलो इस्तेमाल किया जा सकता है एक सामान्य अर्थ में, या उपसर्गों फ्लोरो, क्लोरीन, ब्रोमिन- , आयोडीन और ndash; के लिए विशिष्ट हैलोजन । हलोजन तत्व हो सकता है एक क्रॉस कनेक्शन के गठन के साथ द्विपरमाणुक अणुओं के साथ ध्रुवीय सहसंयोजक एकल बांड.
अधिक:
प्राकृतिक आदमी की जरूरतों: प्रकार के और तरीके को पूरा करने के लिए
प्राकृतिक आदमी की जरूरतों कई हैं । के रूप में और सामाजिक. यह मानव स्वभाव है करने के लिए कभी भी जरूरत है. और जब वह लगता है के लिए एक तीव्र आवश्यकता में कुछ भी है, वह कोशिश करता है को संतुष्ट करने के लिए. हालांकि, क्रम में सब कुछ.अवधारणाइससे पहले कि मै...
नाम के महीने में यूक्रेनी भाषा
नाम के महीने में यूक्रेनी और अलग अलग भाषाओं में स्पष्ट है अलग ढंग से. कई स्लाव भाषाओं में, वे समान हैं । चलो देखते हैं कि कैसे अलग-अलग नाम हैं, मौसम के अलग अलग देशों में.का नाम महीने में यूक्रेनीमें यूक्रेनी भाषा के नाम पर वर्ष के प्रत्येक महीने के ल...
निबंध के लिए "बुद्धि से हाय": क्यों इस खेल के लिए प्रासंगिक आधुनिक समाज?
A. S. Griboyedov लिखा एक नाटक बन गया है, जो नींव के शास्त्रीय रूसी साहित्य । उस में, वह बहुत सही रूप में वर्णित सामाजिक बुराइयों निहित हैं कि आधुनिक समाज में. इसलिए, निबंध का उत्पाद है "बुद्धि से हाय" अनिवार्य है स्कूल के पाठ्यक्रम में.के बारे में सं...
क्लोरीन (Cl2) पहली बार था हलोजन खोला जा करने के लिए 1774 में है, तो खोज रहे थे आयोडीन (मैं2), ब्रोमीन (Br2), फ्लोरीन (F2), और astatine (पर, की खोज की अंतिम 1940 में). नाम “हेलो” से आता है, ग्रीक जड़ों की हैल- (“नमक”) और पीढ़ी (“प्रपत्र”). साथ में, इन शब्दों का मतलब “नमक”, पर प्रकाश डाला तथ्य यह है कि हलोजन के साथ प्रतिक्रिया करता है धातुओं के लवण फार्म. Galit – के नाम सेंधा नमक, एक प्राकृतिक खनिज की रचना सोडियम क्लोराइड (NaCl). और अंत में, हैलोजन इस्तेमाल कर रहे हैं रोजमर्रा की जिंदगी में – एक फ्लोराइड टूथपेस्ट में निहित, क्लोरीन disinfects पीने के पानी, और आयोडीन थायराइड हार्मोन को बढ़ावा देता है.
रासायनिक तत्वों
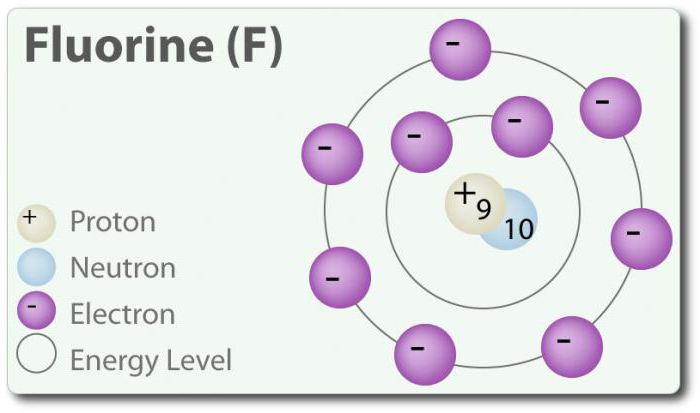
फ्लोराइड – तत्व के साथ परमाणु संख्या 9, प्रतीक द्वारा प्रतिनिधित्व किया F. मौलिक फ्लोरीन पहले की खोज की थी में 1886 से यह अलग से hydrofluoric एसिड. स्वतंत्र राज्य में फ्लोरीन के रूप में मौजूद है एक द्विपरमाणुक अणु (F2) और सबसे प्रचुर मात्रा में हलोजन पृथ्वी की पपड़ी में. फ्लोरीन-सबसे अधिक निद्युत तत्व आवर्त सारणी में. कमरे के तापमान पर एक पीला पीले रंग की गैस है । फ्लोरीन भी एक अपेक्षाकृत छोटे परमाणु त्रिज्या. इसके साथ – -1, को छोड़कर के लिए मौलिक द्विपरमाणुक राज्य में जो अपने ऑक्सीकरण राज्य शून्य है । फ्लोरीन अत्यंत प्रतिक्रियाशील और सीधे सूचना का आदान प्रदान के साथ सभी तत्वों को छोड़कर हीलियम (वह), नीयन (Ne) और आर्गन (Ar). की एक समाधान में H2O, hydrofluoric एसिड (HF) एक कमजोर अम्ल है. हालांकि फ्लोरीन अत्यधिक निद्युत, इसकी वैद्युतीयऋणात्मकता निर्धारित नहीं करता है अम्लता; HF है, एक कमजोर एसिड के कारण तथ्य यह है कि फ्लोराइड आयन बुनियादी है (पीएच> 7). इसके अलावा, फ्लोरीन उत्पादन बहुत शक्तिशाली oxidants. उदाहरण के लिए, फ्लोरीन के साथ प्रतिक्रिया कर सकते अक्रिय गैस क्सीनन और रूपों एक मजबूत ऑक्सीकरण एजेंट क्सीनन difluoride (XeF2). और फ्लोरीन कई का उपयोग करता है.
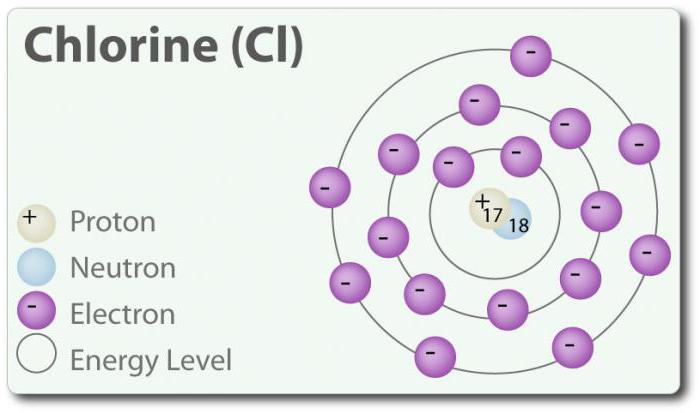
क्लोरीन और ndash; तत्व के साथ परमाणु संख्या 17 और रासायनिक प्रतीक सीएल. की खोज की 1774 में, यह अलग से हाइड्रोक्लोरिक एसिड. में अपने मौलिक राज्य में, यह रूपों एक द्विपरमाणुक अणु Cl2. क्लोरीन कई से: -1, +1, 3, 5 और 7. कमरे के तापमान पर यह एक हरे रंग पीला गैस. क्योंकि बांड का गठन किया है कि दोनों के बीच क्लोरीन परमाणुओं कमजोर है, अणु Cl2 है एक बहुत ही उच्च क्षमता है में प्रवेश करने के लिए कनेक्शन. क्लोरीन के साथ प्रतिक्रिया करता है धातुओं के लवण फार्म कहा जाता क्लोराइड. क्लोराइड आयनों के साथ कर रहे हैं सबसे आम आयनों में निहित समुद्र का पानी है । क्लोरीन के दो आइसोटोप: 35सीएल और 37सीएल. सोडियम क्लोराइड है सबसे आम कनेक्शन के सभी क्लोराइड.
ब्रोम – रासायनिक तत्व के साथ परमाणु संख्या 35 और प्रतीक Br. यह पहली बार पता चला था में 1826 में मौलिक रूप है द्विपरमाणुक ब्रोमीन के अणु Br2. कमरे के तापमान पर एक लाल-भूरे रंग के तरल. इसके साथ – -1, + 1, 3, 4 और 5. ब्रोमीन है की तुलना में अधिक सक्रिय आयोडीन, लेकिन कम सक्रिय क्लोरीन की तुलना में. इसके अलावा, ब्रोमीन के दो आइसोटोप: 79Br तथा 81वी. जी. ब्रोमीन पाया जाता है के रूप में ब्रोमाइड लवण भंग में समुद्र का पानी है । हाल के वर्षों में, उत्पादन के ब्रोमाइड दुनिया में काफी वृद्धि हुई है के कारण इसकी आसान उपलब्धता और लंबे जीवन समय के साथ । की तरह अन्य हैलोजन, ब्रोमीनएक आक्सीकारक और अत्यधिक विषाक्त है.
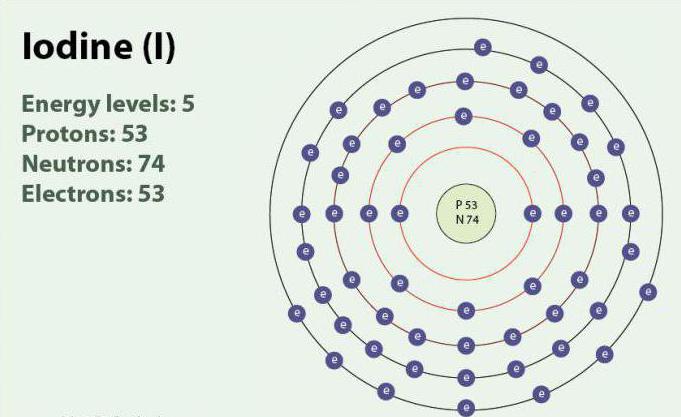
आयोडीन-रासायनिक तत्वों के साथ परमाणु संख्या 53 और प्रतीक I. आयोडीन ऑक्सीकरण राज्यों: -1, +1, +5 +7. मौजूद है के रूप में एक द्विपरमाणुक अणु, मैं2. कमरे के तापमान पर एक ठोस बैंगनी रंग है. आयोडीन एक स्थिर आइसोटोप 127मैं पहली बार पता चला 1811 में समुद्री शैवाल की मदद से, और सल्फ्यूरिक एसिड. वर्तमान में, आयनों, आयोडीन की अलग किया जा सकता समुद्र के पानी में. के बावजूद तथ्य यह है कि आयोडीन नहीं है पानी में बहुत घुलनशील, इसकी विलेयता में वृद्धि हो सकती है यदि आप का उपयोग कुछ iodides. आयोडीन एक महत्वपूर्ण भूमिका निभाता है शरीर में सहायता करने में थायराइड हार्मोन के उत्पादन.<आइएमजी alt="रासायनिक गुणों के Halogens" ऊंचाई="412" src="/images/2018-Apr/02/77a1fbb42faeb74145a27aa80ea8fede/4.jpg" चौड़ाई="412" />
ASTAT – एक रेडियोधर्मी तत्व के साथ एक परमाणु की संख्या 85 है और प्रतीक है । इसके संभव ऑक्सीकरण राज्यों: -1, +1, 3, 5 और 7. केवल हलोजन नहीं है कि एक द्विपरमाणुक अणु. सामान्य परिस्थितियों के अंतर्गत, धातु ठोस काला है । Astatine एक बहुत ही दुर्लभ तत्व है, तो यह थोड़ा जाना जाता है । इसके अलावा, astatine एक बहुत ही कम आधा जीवन है नहीं की तुलना में अब कुछ ही घंटे. प्राप्त 1940 में एक परिणाम के रूप में संश्लेषण. मुझे विश्वास है कि astatine इसी तरह की है करने के लिए आयोडीन. विभिन्न धातु गुण है ।
नीचे दी गई तालिका से पता चलता की संरचना हलोजन परमाणुओं की संरचना की बाहरी परत के इलेक्ट्रॉनों.
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 319px;">हेलो
इलेक्ट्रॉन विन्यास
फ्लोरीन
12 2s2 2p5
क्लोरीन
3s2 3 पी5
ब्रोम
3 डी10 4s2 4p5
आयोडीन
4d10 5 एस2 5p5
Astatine
4f14 5d10 6s2 6p5
इस संरचना का एक बाहरी परत के इलेक्ट्रॉनों को निर्धारित करता है भौतिक और रासायनिक गुणों के Halogens के समान हैं । हालांकि, जब इन की तुलना आइटम, मतभेद मनाया गया.
आवधिक गुणों के समूह में हैलोजन
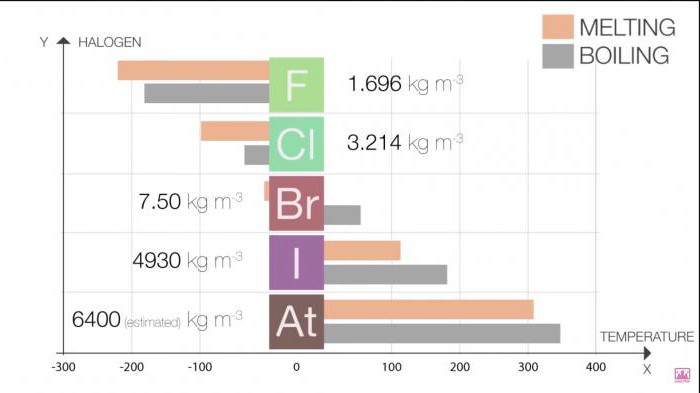
के भौतिक गुणों सरल यौगिकों के Halogens परिवर्तन में वृद्धि के साथ क्रमसूचक संख्या के तत्व. बेहतर अवशोषण के लिए और अधिक से अधिक स्पष्टता के लिए, हम आप की पेशकश कुछ तालिकाओं.
गलनांक और क्वथनांक में वृद्धि में वृद्धि के आकार का अणु (एफ एंड लेफ्टिनेंट;Cl <Br &लेफ्टिनेंट;मैं और लेफ्टिनेंट;में). इस वृद्धि में वृद्धि का मतलब की ताकत वान डर वाल्स.
तालिका 1. हैलोजन । भौतिक गुण: गलनांक और उबलते बिंदु है
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 472px;">हेलो
टी पिघलने (C)
टी उबलते बिंदु (C)
फ्लोरीन
-220
-188
क्लोरीन
-101
-35
ब्रोम
-7.2
58.8
आयोडीन
114
184
Astatine
302
337
- परमाणु त्रिज्या बढ़ जाती है.
मूल आकार बढ़ जाती है (एफ एंड लेफ्टिनेंट; Cl < Br &लेफ्टिनेंट; मैं और लेफ्टिनेंट; में), के रूप में यह बढ़ जाती है की संख्या में प्रोटॉन और न्यूट्रॉन. इसके अलावा, प्रत्येक अवधि के लिए कहते हैं और अधिक ऊर्जा का स्तर. यह करने के लिए सुराग, अधिक से अधिक कक्षीय, और इसलिए बढ़ाने के लिए त्रिज्या के परमाणु है.
तालिका 2. हैलोजन । भौतिक गुण: परमाणु त्रिज्या
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 75%;">हलोजन
सहसंयोजक त्रिज्या (PM)
आयन (X-) त्रिज्या (PM)
फ्लोरीन
71
133
क्लोरीन
99
181
ब्रोम
114
196
आयोडीन
133
220
Astatine
150
- आयनीकरण ऊर्जा कम हो जाती है.
यदि बाहरी valence इलेक्ट्रॉनों नहीं कर रहे हैं, नाभिक के पास है, तो यह को हटाने की जरूरत नहीं होगी, ऊर्जा का एक बहुत. इस प्रकार, आवश्यक ऊर्जा बेदखल करने के लिए बाहरी इलेक्ट्रॉनों नहीं कर रहे हैं, तो उच्च के तल पर समूह के तत्वों, के रूप में वहाँ है और अधिक ऊर्जा का स्तर. इसके अलावा, उच्च ऊर्जा ionization तत्व बनाता है होना करने के लिए गैर-गुणवत्ता की है । आयोडीन और astatine प्रदर्शन धातु गुणों का प्रदर्शन, क्योंकि आयनीकरण ऊर्जा कम हो जाती है (पर और लेफ्टिनेंट; मैं और लेफ्टिनेंट; Br < Cl और लेफ्टिनेंट; एफ).
3 टेबल. हैलोजन । भौतिक गुण: आयनीकरण ऊर्जा
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 50%;">हेलो
ऊर्जा ionization (केजे/मोल)
फ्लोरीन
1681
क्लोरीन
1251
ब्रोम
1140
आयोडीन
1008
Astatine
890 ± 40
- वैद्युतीयऋणात्मकता कम हो जाती है.
की संख्या valence इलेक्ट्रॉनों एक परमाणु में बढ़ जाती है में वृद्धि के साथ ऊर्जा के स्तर में उत्तरोत्तर निचले स्तर पर. प्रगतिशील इलेक्ट्रॉनों आगे से नाभिक है; इस प्रकार, नाभिक और इलेक्ट्रॉन नहीं कर रहे हैं के रूप में आकर्षित कियाएक दूसरे के लिए. में वृद्धि के साथ, परिरक्षण मनाया जाता है. इसलिए, वैद्युतीयऋणात्मकता कम हो जाती है में वृद्धि के साथ, अवधि (और लेफ्टिनेंट; मैं और लेफ्टिनेंट; Br < Cl और लेफ्टिनेंट; एफ).
तालिका 4. हैलोजन । भौतिक गुण: वैद्युतीयऋणात्मकता
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 50%;">हेलो
वैद्युतीयऋणात्मकता
फ्लोरीन
4.0
क्लोरीन
3.0
ब्रोम
2.8
आयोडीन
2.5
Astatine
2.2
- इलेक्ट्रॉन आत्मीयता कम हो जाती है.
के आकार के रूप में एटम के साथ बढ़ जाती है बढ़ रही है की अवधि, इलेक्ट्रॉन आत्मीयता आम तौर पर कम हो जाती है (और लेफ्टिनेंट; मैं और लेफ्टिनेंट; Br < एफ एंड लेफ्टिनेंट; सीएल). अपवाद – फ्लोरीन, आत्मीयता है, जो की तुलना में कम है कि क्लोरीन की. इस से समझाया जा सकता है छोटे आकार के फ्लोरीन की तुलना में क्लोरीन के लिए.
5 तालिका. आत्मीयता के Halogens करने के लिए इलेक्ट्रॉन
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 50%;">हेलो
इलेक्ट्रॉन आत्मीयता (केजे/मोल)
फ्लोरीन
-328.0
क्लोरीन
-349.0
ब्रोम
-324.6
आयोडीन
-295.2
Astatine
-270.1
- जेट के तत्वों कम हो जाती है.
जेट Halogens के कम हो जाती है में वृद्धि के साथ, अवधि (और लेफ्टिनेंट;मैं और लेफ्टिनेंट;Br <Cl और लेफ्टिनेंट;F) । इस वजह से वृद्धि करने के लिए के दायरे में एटम के साथ वृद्धि हुई ऊर्जा के स्तर में इलेक्ट्रॉनों की. यह कम कर देता है के आकर्षण के valence इलेक्ट्रॉनों के लिए अन्य परमाणुओं, कम जेट. इस कमी का भी कारण होता है के लिए गिरावट की वैद्युतीयऋणात्मकता के साथ बढ़ रही है की अवधि, जो भी कम कर देता है के आकर्षण के इलेक्ट्रॉनों. इसके अलावा, के बढ़ते आकार के साथ परमाणु घट जाती है और oxidative क्षमता.
अकार्बनिक रसायन शास्त्र है. हाइड्रोजन + हैलोजन
के Halide का गठन जब एक हलोजन के साथ प्रतिक्रिया करता है एक और, कम निद्युत तत्व के गठन के साथ बाइनरी यौगिकों. हाइड्रोजन के साथ प्रतिक्रिया करता है Halogens करने के लिए फार्म halides के रूप HX:
<उल>हाइड्रोजन Halides आसानी से भंग करने के लिए पानी में फार्म halogenoalkanes (hydrofluoric, हाइड्रोक्लोरिक, bromatological, itestosterone एसिड). गुण इन एसिड के नीचे दिए गए हैं.
एसिड द्वारा गठित निम्न प्रतिक्रिया: HX (aq) + H2O (एल) → X- (aq) + H3O+ (aq).
सभी halomonadaceae फार्म मजबूत एसिड होता है, को छोड़कर HF.
अम्लता के hydrohalic एसिड बढ़ जाती है: HF <एचसीएल और लेफ्टिनेंट;HBr और लेफ्टिनेंट;हाय.
Hydrofluoric एसिड खोदना कर सकते हैं कांच और कुछ अकार्बनिक fluorides एक लंबे समय के लिए.
यह counterintuitive लग सकता है कि HF सबसे कमजोर है halogenation एसिड, क्योंकि फ्लोरीन उच्चतम वैद्युतीयऋणात्मकता. हालांकि, बांड एन-एफ है, बहुत मजबूत एसिड के कारण बहुत कमजोर है । एक मजबूत बांड द्वारा निर्धारित किया जाता है की कम लंबाई के लिंक और एक बड़ी हदबंदी ऊर्जा. के सभी हाइड्रोजन halides, HF है, कम से कम लंबाई के लिए संचार और सबसे बड़ी ऊर्जा के बंधन हदबंदी.
हलोजन oxoacid
हलोजन oxoacid का प्रतिनिधित्व एसिड के साथ परमाणुओं से हाइड्रोजन, ऑक्सीजन और हैलोजन । उनके अम्लता द्वारा निर्धारित किया जा सकता संरचना का विश्लेषण. हलोजन oxoacid नीचे दिखाया गया है:
<उल>इनमें से प्रत्येक में एसिड प्रोटॉन के लिए जुड़ा हुआ ऑक्सीजन परमाणु है, इसलिए, की तुलना में बांड की लंबाई प्रोटॉन बेकार हैं । प्रमुख भूमिका के द्वारा खेला जाता है वैद्युतीयऋणात्मकता. की गतिविधि एसिड के साथ बढ़ जाती है की संख्या में वृद्धि हुई ऑक्सीजन परमाणु के साथ जुड़े केंद्रीय परमाणु है.
प्रकटन और राज्य के मामले
मुख्य भौतिक गुणों के Halogens जा सकता है, संक्षेप में व्यक्त की निम्न तालिका में.
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0">राज्य के मामला (कमरे के तापमान)
हेलो
प्रकटन
ठोस
आयोडीन
बैंगनी
Astatine
काले
तरल
ब्रोम
लाल-भूरे रंग
गैसीय
फ्लोरीन
पीले रंग पीला-भूरा
क्लोरीन
हरे रंग पीला
स्पष्टीकरण की उपस्थिति
का रंग हैलोजन एक परिणाम के अवशोषण के दृश्यमान प्रकाश द्वारा अणुओं का कारण बनता है, जो उत्तेजना के इलेक्ट्रॉनों. फ्लोरीन वायलेट प्रकाश को अवशोषित कर लेता है, और इसलिए लग रहा है, हल्के पीले रंग की । आयोडीन, पर इसके विपरीत, पीले प्रकाश को अवशोषित कर लेता है और यह लग रहा है बैंगनी (पीले और बैंगनी – पूरक रंग). रंग की हैलोजन बन गहरे रंग के साथ बढ़ रही है की अवधि.
बंद कंटेनर में तरल ब्रोमीन और आयोडीन कर रहे हैं के साथ संतुलन में अपने वाष्प, जो मनाया जा सकता है के रूप में एक रंग की गैस है ।
हालांकि रंग की astatine अज्ञात है, यह माना जाता है यह जरूरत है कि किया जा करने के लिए गहरे रंग आयोडीन (यानी काला) के अनुसार पैटर्न मनाया.
अब, अगर आप कर रहे हैं कहा: “वर्णन के भौतिक गुणों हैलोजन”, आप कहने के लिए कुछ है.
ऑक्सीकरण राज्य की हैलोजन यौगिकों में
ऑक्सीकरण की डिग्री अक्सर इस्तेमाल किया जाता है के बजाय की अवधारणा "valence के Halogens". एक नियम के रूप में, ऑक्सीकरण के राज्य -1. लेकिन अगर हलोजन के साथ जुड़ा हुआ है ऑक्सीजन के साथ या एक हलोजन, यह ले सकता है एक अन्य की हालत: ऑक्सीजन है -2 प्राथमिकता है । के मामले में दो अलग-अलग हलोजन परमाणुओं एक साथ बंधुआ है, और अधिक निद्युत परमाणु की तस है और साथ लेता है -1.
उदाहरण के लिए, क्लोराइड, आयोडीन की (आईसीएल) क्लोरीन एक -1, और आयोडीन +1. क्लोरीन अधिक निद्युत से आयोडीन, तो यह है के साथ -1.
में ब्रोमीन एसिड (HBrO4), ऑक्सीजन के साथ -8 (-2 x 4 परमाणुओं = -8). हाइड्रोजन एक कुल ऑक्सीकरण अवस्था +1 है. के अलावा इन मूल्यों को देता है के साथ -7. के रूप में अंत के साथ कनेक्शन होना चाहिए शून्य है, तो ब्रोमीन है +7.
तीसरे नियम के अपवाद नहीं है ऑक्सीकरण राज्य की halogen में मौलिक रूप (X2) है, जहां यह शून्य से है ।
<तालिका align="केन्द्र" cellpadding="5" cellspacing="0" शैली="चौड़ाई: 75%;">हेलो
में कनेक्शन
फ्लोरीन
-1
क्लोरीन
-1, +1, +3, +5, +7
ब्रोम
-1, +1, +3, +4, +5
आयोडीन
-1, +1, +5, +7
Astatine
-1, +1, +3, +5, +7
क्यों फ्लोरीन हमेशा -1?
वैद्युतीयऋणात्मकता के साथ बढ़ जाती है बढ़ रही है की अवधि. इसलिए, फ्लोरीन उच्चतम वैद्युतीयऋणात्मकता के सभी तत्वों, के रूप में द्वारा evidenced अपनी स्थिति में आवर्त सारणी. अपनी इलेक्ट्रॉनिक विन्यास है 1s2 2s2 2p5. यदि फ्लोराइड हो जाता है एक और अधिक इलेक्ट्रॉन, बाहरी p-कक्षाओं पूरी तरह से भरा है और कर रहे हैं एक पूर्ण octet में है । के बाद से फ्लोरीन के उच्च वैद्युतीयऋणात्मकता, यह कर सकते हैं आसानी से ले एक इलेक्ट्रॉन एक पड़ोसी से परमाणु है. फ्लोरीन इस मामले में isoelectronic अक्रिय गैस (आठ valence इलेक्ट्रॉनों), सभी बाहरी कक्षाओं से भर रहे हैं. इस स्थिति में, फ्लोरीन और अधिक स्थिर है.
उत्पादन और उपयोग के Halogens
प्रकृति में, हैलोजन के एक राज्य में हैं anions, तो नि: शुल्क हैलोजन ऑक्सीकरण द्वारा उत्पादित द्वारा इलेक्ट्रोलिसिस का उपयोग कर या ऑक्सीकरण एजेंट. उदाहरण के लिए, क्लोरीन उत्पादन किया है की हाइड्रोलिसिस द्वारा नमक समाधान है । के उपयोग हैलोजन और उनके यौगिकों विविध रहे हैं ।
<उल><ली>फ्लोराइड. के बावजूद तथ्य यह है कि फ्लोरीन बहुत प्रतिक्रियाशील है, यह कई उद्योगों में इस्तेमाल किया. उदाहरण के लिए, यह एक प्रमुख घटक के polytetrafluoroethylene (Teflon) और अन्य fluoropolymers. सीएफसी कर रहे हैं कार्बनिक रसायन गया है कि पूर्व के रूप में इस्तेमाल के refrigerants और प्रणोदक में एयरोसौल्ज़. उनके उपयोग बंद करने के कारण उनके संभव पर्यावरण पर प्रभाव. वे द्वारा प्रतिस्थापित किया गया hydrochlorofluorocarbons. फ्लोराइड जोड़ा गया है करने के लिए टूथपेस्ट (SnF2) और पीने के पानी (NaF) के लिए दाँत क्षय को रोकने के. इस हलोजन है, मिट्टी में निहित के उत्पादन के लिए इस्तेमाल के कुछ प्रकार की चीनी मिट्टी की चीज़ें (LiF) में प्रयोग किया जाता है परमाणु ऊर्जा (UF6) प्राप्त करने के लिए एंटीबायोटिक फ़्लोरोक्विनोलोन, एल्यूमीनियम (Na3AlF6), के अलगाव के लिए उच्च वोल्टेज उपकरण (एस एफ6).
Article in other languages:

Alin Trodden - लेख के लेखक, संपादक
"हाय, मैं कर रहा हूँ Alin दलित. मैं ग्रंथ लिखता हूं, किताबें पढ़ता हूं, और छापों की तलाश करता हूं । और मैं आपको इसके बारे में बताने में बुरा नहीं हूं । मैं दिलचस्प परियोजनाओं में भाग लेने के लिए हमेशा खुश हूं."
संबंधित समाचार
डाल करने के लिए कैसे उच्चारण में शब्द "विपणन"? विपणन: पर जो शब्दांश उच्चारण है?
एक बहुत कुछ के शब्दों में रूसी कर रहे हैं, अन्य भाषाओं से उधार लिया: फ्रेंच, अंग्रेजी, ग्रीक, जर्मन, इतालवी और दूसरों. और सवाल अक्सर उठता है, जहां के बारे में जोर डाल करने के लिए शब्द "मार्केटिंग", "कर्लिंग", "उदासीन", "भेदभाव", "...
क्या उपपरमाण्विक कण है एक सकारात्मक चार्ज?
सभी बात है के तत्वों. लेकिन क्यों हमारे चारों ओर सब कुछ बहुत अलग है? जवाब से जुड़ा हुआ है करने के लिए छोटे कणों. वे कहते हैं प्रोटॉन. के लिए इसके विपरीत में, इलेक्ट्रॉनों नकारात्मक चार्ज, इन subatomic कणों एक सकारात्मक चार्ज. क्या...
कविता का विश्लेषण "घर में रहनेवाला" पुश्किन: एक शैलीगत और compositional सुविधाएँ
अलेक्जेंडर पुश्किन कविता लिखी ही नहीं प्यार के बारे में या प्रकृति का वर्णन है. कोई कम से कम लोकप्रिय था, अपने प्रसिद्ध कहानी है, लिखा है, कविता के रूप में. वे प्रवेश किया एक परी की कहानी के लिए कहा था, कवि द्वारा उसकी नानी Arina ...
सर्वश्रेष्ठ विश्वविद्यालयों कजाखस्तान के
स्नातकों स्नातक होने के बाद, सवाल उठता है: जहां जाने के लिए, क्या विश्वविद्यालय, कॉलेज, स्कूल जाने के लिए? इस विषय की पसंद - नहीं अपवाद है, और युवा लोगों के लिए कजाकिस्तान के. ध्यान दें कि के साथ युवा लोगों के लिए एक महान इच्छा के...
अलेक्सई Mikhailovich के शासनकाल शांत. आदेश के गुप्त मामलों
स्थापना के आदेश के गुप्त मामलों (वर्ष के गठन के लगभग 1653-y) द्वारा शुरू की, अलेक्सई Mikhailovich शांत, दो गोल था. एक हाथ पर, इसे इस्तेमाल किया गया था के रूप में एक निजी कार्यालय के सम्राट. दूसरे पर - आदेश के रहस्य मामलों के रूप म...
कप्तान एक रैंक में Cossack सेना
कप्तान और ndash; एक रैंक में Cossack सेना. पहले यह कहा जाता था के सहायक कमांडर, बाद कप्तान बराबर हो सकता है के साथ कप्तान या कप्तान । क्या होता है इस शब्द का क्या मतलब है?व्युत्पत्तिएक संस्करण के अनुसार, Esaul – यह एक शब्द क...






















टिप्पणी (0)
इस अनुच्छेद है कोई टिप्पणी नहीं, सबसे पहले हो!