Aggregatzustand des Kochsalzes. Kochsalz, Chemie
Mehr als 10 Millionen organische und mehr als 500 tausend anorganischen verbindungen bekannt Chemikern auf den heutigen Tag. Unter Ihnen gibt es komplexe Struktur und Eigenschaften, die gelten nur in chemischen oder medizinischen Zwecken. Und es gibt diejenigen, die nicht schwer zu beschaffen sind und sehr Häufig im Alltag. Aber nicht weniger wichtig und bedeutsam sind. Zu einem von diesen Stoffen gehört das Kochsalz. Im Alltag nennt noch Lebensmittel und in der chemischen Industrie als Natriumchlorid oder chlorhaltigen Natrium. In der technologischen Industrie ist es als Mineralstoff, der es bildet in der Natur, - галитом sowie Salzstein oder festen Steinsalz. Betrachten wir Aggregatzustand Kochsalz, Struktur, Eigenschaften, Gewinnung, Anwendung und Einführung in die Geschichte der Massenkonsum.

In welchen Zuständen besteht Kochsalz?
Was ist der Aggregatzustand der Stoffe und wie es geschieht? Es hängt davon ab, um welche Substanz es sich handelt. Jeder Schüler im Alter von 7 Klasse nennen kann Aggregatzustand Kochsalz, denn es ist die Substanz, die sich bei jedem zu Hause. Heute ohne ihn ist schwer für den heutigen Menschen vorstellen, ein Leben. Darüber hinaus Aggregatzustand des Kochsalzes ganz offensichtlich mit dem bloßen Auge - fein oder grob disperse richtigen Kristalle der kubischen Form. Jedoch, gelöste Salz im Wasser, wir bekommen es schon in einem anderen Aggregatzustand - flüssiger. Dasselbe erhalten wir, wenn nur расплавим Kristalle bei hohen Temperaturen. Die einzige Bedingung, die nicht typisch für Salz, ist gasförmig. Aber unter bestimmten Bedingungen ist es möglich, bekommen.
Mehr:
Das Deutsche Flugzeug "Messerschmitt-262": die Geschichte der Entstehung, Merkmale, Foto
High-Speed-Strahltriebwerk-Kämpfer-Abfangjäger Messerschmitt ME-262 Schwalbe („Messerschmitt ME-262 Schwalbe») erschien auf dem Schlachtfeld nur im Jahr 1944. Man kann nicht genau sagen, für welchen Job diese Maschine bestimmt. Experiment...
Moderne Schule: Geschichte, Voraussetzungen, Probleme. Modelle der modernen Schulen
Historische Entstehung von Schulen förderte den Wunsch der Menschen die Welt zu erkennen und erweitern Ihre Kenntnisse. Deshalb versucht der Mensch zur Gemeinschaft mit den weisen und sehnte sich danach von Ihnen zu lernen wissen.die Geschichte der m...
"Haare zu Berge": Bedeutung, Herkunft фразеологизма
In der Russischen Sprache treffen eine ausreichende Anzahl von geheimnisvollen Floskeln, über deren Bedeutung schwer zu erraten. Die sprachliche Konstruktion „die Haare» gehört eindeutig zu den solchen. Zum Glück, der Ursprung dieses Ausd...
Bedingungen für die änderung des Aggregatzustandes
- Um das Salz in flüssigem Zustand durch Schmelzen der festen Kristalle natürlichen Ursprungs, müssen Sie die Temperatur von 800S.
- Für die übersetzung des Salzes in den gasförmigen Zustand geschmolzene Kristalle brauchen zum Kochen bringen (etwa 1400C) und Kochen bis zum vollständigen übergang von strukturellen Komponenten in Ionen (Na+ CL-).
- Feste Aggregatzustand von Kochsalz - es ist Ihr natürliches Aussehen unter natürlichen Bedingungen.

Warum dies geschieht die Streuung der Temperaturen bei den Manipulationen mit Kristallen? Dies wird durch die Struktur des Kristallgitters.
Das Kristallgitter
Es ist eine richtige гранецентрированные kubische transparente Kristalle. In jeder Ecke des Würfels (Knoten Kristallgitter) sind abwechselnd positiv geladene Ionen Na+ und negativ geladenen Ionen CL-. Dank der stark различающейся in der Elektronegativität dieser Atome zwischen Ihnen entsteht so eine starke elektrostatische Anziehung, die für seine Zerstörung zu setzen, müssen die harten Bedingungen (hohe Temperatur, mechanische Einwirkung). Diese Art von Kristallgitter trägt den Titel Ionen, und er ist charakteristisch für alle Salze von Alkali -, Alkali-Erde und übergangsmetall.
Deshalb die Temperatur des Kochsalzes (wie für Schmelz-und Siedetemperatur) so hoch ist. Jedoch erhalten Sie Kristalle nicht nur würfelförmigen, sondern pyramidal (acht-, zwölf - und двадцатигранной). Dazu müssen Sie lediglich die Temperatur der Verdampfung salzigen Lösung in einer bestimmten Weise. In jedem Fall wird der innere Hohlraum der Kristalle mit Flüssigkeit gefüllt bleibt, wenn es darum geht, eine Lösung von Salz in Wasser.
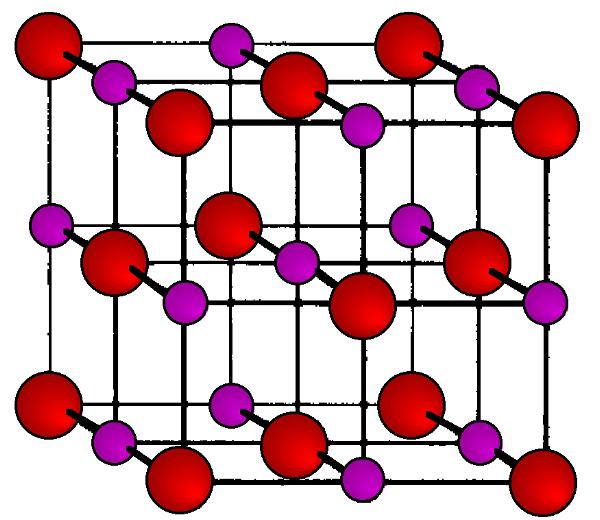
Die Chemische Formel für Natriumchlorid ist einfach und drückt sich elementar Zusammensetzung NaCL.
Physikalische Eigenschaften Halit
Die Physikalischen Eigenschaften von Natriumchlorid kann ein paar Punkte zu beschreiben:
- Feste Kristalle weiß, rosa, blau, Violett, rot. Die Färbung hängt von der Anwesenheit von Verunreinigungen bei der Gewinnung. Reinstoff Kristall in der Farbe weiß.
- Löst sich in Wasser im Verhältnis von etwa 100/30 (in 100 G Wasser 30 G Salz). Gute Löslichkeit aufgrund der Anwesenheit von Dipolen des Wassers, die assoziieren, um sich die Ionen Natrium und Chlor, wodurch die Zerstörung der elektrostatischen Anziehung zwischen Ihnen und als Folge die Zerstörung der Kristallgitter.
- Schmilzt und verdampft bei hohen Temperaturen (zwischen 800 und 1400).
- Hat eine kaum wahrnehmbare angenehmen Geruch.
- Salzigen Geschmack.

Chemische Eigenschaften von Natriumchlorid
Wie jede Durchschnittliche lösliche Salz, das Natriumchlorid ist in der Lage, treten in Interaktion mit:
- Andere Salze durch die austauschreaktion (Voraussetzung: Reaktionen, Gasentwicklung, Abscheidung von Schlamm oder Bildung малодиссоциируемого Stoffe): NaCL + AgNO3 = NaNO3 + AgCL (weiß tvorožistyj Pellet). Diese hochwertige Reaktion auf Ionen CL-.
- Mit Metallen, die sich in ЭХРНМ Links Natrium: Zu + NaCL = KCL + Na.
- Dissoziiert in wässriger Lösung auf freie wässrige Dipolen Wasser Ionen: NaCL (Wasserlösung) = Na+ + CL-. Das Ergebnis ist eine Lösung von Kochsalz, das ist ein starker Elektrolyt.
- Unterliegt nicht der Hydrolyse, da ist ein Salz, gebildet von einer starken Säure und einer starken Base.
- Bei der Elektrolyse (die Wirkung des elektrischen Stromes) zersetzt sich mit der Bildung von freien Produkte undNatronlauge (ätzend): NaCL = Na + Cl2 + NaOH.
Wo in der Natur enthält Natrium-Chlorid?
Derzeit Kochsalz - eine Substanz, die oft in der Natur begegnet. Und so war es zwar immer, aber in Antike und Mittelalter galt Sie als sehr teures Produkt. All dies aus der Tatsache, dass Sie nicht wissen, Möglichkeiten der Gewinnung von Salz aus natürlichen Quellen. Und solche Quellen in der weltweiten Vorräte sehr viel - Halit gilt als fast unbegrenzte Natürliche Ressource. Wo aber das Salz ist in der Natur?
- Die Meere und Ozeane mit Salzwasser.
- Salzseen.
- Salzigen Quellen.
- Grundwasser.
- Wasser von Flussmündungen.

Bergbau Halit
Extraktion und Verarbeitung von Salz haben Ihre eigene Technologie, da nur der gewonnene Substanz meistens zum Verzehr ungeeignet aufgrund des hohen Gehaltes an Verunreinigungen. Abgebaut Halit unterschiedlich, zum Beispiel:
- Durch die unterirdischen arbeiten;
- Der Schichten auf dem Boden der Salinen Gewässern;
- Durch verdampfen oder вымораживаем salzigen Meerwasser oder Meerwasser;
- Verdunstung des Grundwassers.
Irgendeine Möglichkeit gibt die Möglichkeit, die Halit-Kristalle. Aber für den menschlichen Verzehr müssen Sie noch eine Art der Verarbeitung - das mahlen. Denn kaum jemand nutzt zu Hause beim Kochen ein großer Kristall des Kochsalzes. Meistens erwerben in einem bereits gereinigten von Verunreinigungen, zerquetschten praktisch in Form von Pulver. Auch sind die verschiedenen Arten von Salz jodiertes, fluoridiertes und so weiter nicht nur für Lebensmittel, sondern auch technische Zwecke.
Anwendung Steinsalz
Die Einsatzgebiete und die Verwendung von Natriumchlorid sehr umfangreich. Die wichtigsten sind zusammen mit den Beispielen und den Ergebnissen in der Tabelle.
| Branche | Die Grundlage für den Einsatz von Salz | Das Ergebnis |
| Landschaftsbau | Lockerung des Bodens bei niedrigen Temperaturen und die Beseitigung der Leckage von Wasser | Aufbau Bewässerungskanäle und Stauseen |
| Medizin | Ähnlichkeit Salzlösung mit dem Blut des Menschen. Кровезаменяющий Natriumchlorid-Lösung (0,85%), die so genannte physiologische | Wiederherstellung des Gleichgewichts nach umfangreichen кровепотерь, die Normalisierung der Arbeit натрие-Kalium-Pumpe in der Herz-Kreislauf-System, die Aufrechterhaltung einer Konstanten Zusammensetzung des Magensaftes |
| Chemische | Синтезы praktisch relevanten Substanzen auf der Basis von Rohstoffen Natriumchlorid | Erhalten: Natriumhydrogencarbonat, Salzsäure, metallisches Natrium, Chlor, Natronlauge, Glas, Plastik, Seife, Papier und anderen Produkten |
| Food | Antiseptische und antibakterielle Wirkung des Salzes | Konservierung von Lebensmitteln (Fleisch, Fisch, Gemüse), die Verbesserung der geschmacklichen Qualitäten der Nahrung |
| Metallindustrie | Physikalischen und chemischen Eigenschaften des Salzes | Erste Aluminium -, Salz-Batterien, Filter |
| Leder | Antiseptische und antibakterielle Wirkung des Salzes | Verarbeitung von Pelz und Rohleder bei дублении |
Die Geschichte der Entstehung im Alltag
Sol erschien auf den Tischen in jedem Haus nicht sofort. Wenn Sie Gewicht in Gold geschätzt, und zwar im wahrsten Sinne. In dem XVIII Jahrhundert einige Völker Afrikas tauschten eine Handvoll Salz auf eine Handvoll Goldenen Sand. Ein wenig später in äthiopien Keile Salz wurden die Standard-Währung. Im Alten Rom das Militär Legionären sogar monatliche Gehälter Gaben dieser Substanz, was mit der Zeit führte Sie zum benennen der Soldaten. Die Kinder der Armen afrikanischen Völker einfach geleckt steinstücke von Kochsalz als Delikatesse. In den Niederlanden Sie wurde für die Bestrafung der Täter, für die Folter. Quilty Salz überhaupt nicht gegeben, und der Mensch innerhalb kürzester Zeit sterben.
Zum Ersten mal auswählen und konsumiert diese Substanz haben die Menschen gelernt, bereits in der Antike. Dann wurde festgestellt, dass das Salz enthält in den Pflanzen. Deshalb werden Sie verbrannt und die Asche als Gewürz verwendet. Später in China gelernt haben, verdampft das Salz aus dem Meerwasser, und den Prozess der Entwicklung von Methoden zu Ihrer Herstellung begann schneller voranzukommen.

In Russland das Salz abgebaut von Seen (die berühmten Salzseen Russland bis heute - Elton und Baskuntschak). Dann gewerbliche Bedeutung des Stoffes war sehr selten. Erwarben es nur wenige Händler, die dann zu horrenden Preisen verkauft. Leisten haben Sol konnten nur die reichen und berühmten Menschen. Im Laufe der Zeit die Produktion und die Produktion verbessert. Verwendet wurden verschiedene Möglichkeiten der Gewinnung und Verarbeitung, und ist heute eine der häufigsten Haushalts-Substanzen - Kochsalz. Die Chemie dieser Verbindung, Eigenschaften, Anwendung in der Medizin und anderen Branchen bekannt geworden, etwa aus dem XVI-XVII Jahrhundert.
Studium in der Schule-Kurs
Untersuchung der Struktur und Aggregatzustand, sondern auch die chemischen Eigenschaften des Kochsalzes beginnt in der Schule, im Rahmen dieser Disziplin, wie Chemie (8. Klasse). Salz in der Schule Kurs untersucht in Ihrer ganzen Vielfalt in der Natur. Studierende erhalten einen überblick über die chemischen Grundlagen, empirische Formeln, die den grundlegenden physikalischen und chemischen Eigenschaften. Für Leichtigkeit und Komfort Auswendiglernen von Formeln und physikalischen Eigenschaften auf Vorsatzblatt lehrbuch sind in der Regel Salze, die Tabelle gibt einen überblick über Ihre Löslichkeit im Wasser. Dort finden Sie Informationen über die Löslichkeit von Säuren, Laugen und Basen.

Eine Wichtige Eigenschaft der Salze ist Ihre fusibility, auf deren Grundlage baute auch Ihre Beute in der Natur. Die Schüler leicht orientieren Sie sich bei der Lösung der Aufgaben auf fusibility Salz. Tabelle und Grafiken können nicht nur sehen, легкоплавко Stoff oder тугоплавко, sondern bestimmen den ungefähren Schmelzpunkt und Siedepunkt. In der Regel werden solche Tabellen befinden sich auch in den Lehrbüchern ("Chemie", 8. Klasse). Salz sollte untersucht werden im Kontext von Wissenschaften wie Biologie und Physik. So viele Aufgaben für die Schüler gebaut, nämlich auf die Integration межпредметных Beziehungen.
Article in other languages:
AR: https://www.tostpost.com/ar/education/7206-the-aggregate-state-of-the-salt-salt-chemicals.html
En: https://www.tostpost.com/education/20635-the-aggregate-state-of-the-salt-salt-chemicals.html
ES: https://www.tostpost.com/es/la-educaci-n/12900-un-estado-de-la-sal-la-sal-com-n-la-qu-mica.html
HI: https://www.tostpost.com/hi/education/7208-the-aggregate-state-of-the-salt-salt-chemicals.html
JA: https://www.tostpost.com/ja/education/7207-the-aggregate-state-of-the-salt-salt-chemicals.html
KK: https://www.tostpost.com/kk/b-l-m/12894-agregatty-zhay-k-y-as-t-zy-as-t-zy-himiya.html
PL: https://www.tostpost.com/pl/edukacja/12890-stanu-skupienia-soli-s-l-chemia.html
PT: https://www.tostpost.com/pt/educa-o/12885-agregada-do-estado-de-sal-o-sal-comum-qu-mica.html
TR: https://www.tostpost.com/tr/e-itim/12895-fiziksel-durum-tuz-tuz-kimya.html
UK: https://www.tostpost.com/uk/osv-ta/12892-agregatniy-stan-kuhonno-sol-kuhonna-s-l-h-m-ya.html
ZH: https://www.tostpost.com/zh/education/7838-the-aggregate-state-of-the-salt-salt-chemicals.html

Alin Trodden - autor des Artikels, Herausgeber
"Hi, ich bin Alin Trodden. Ich schreibe Texte, lese Bücher und suche nach Eindrücken. Und ich bin nicht schlecht darin, dir davon zu erzählen. Ich freue mich immer, an interessanten Projekten teilzunehmen."
Verwandte News
Russische Staatliche hydrometeorologische Universität: Adresse, Fakultäten
In Russland viele einzigartige Hochschulen, aber die Besondere ist hydrometeorologische Universität, arbeitet in St. Petersburg. Eine solche Hochschule nur eins in unserem Land. Die Einzigartigkeit der Ausbildungsorganisation ange...
Престидижитатор - was ist das? Herkunft und Verwendung des Wortes
In der populären sowjetischen Märchen "Varvara Krasa - lange Nehrung" ein Interessantes Wort erwähnt "престидижитатор". Und obwohl dort die gleiche Erklärung gegeben "in Ihre Mode, es ist престидижитация, unserer Meinung nach, die...
Saratower Konservatorium - Alma Mater im gotischen Stil
die Visitenkarte der Stadt Saratow auf der rechten Seite ist das Saratower Konservatorium namens L. Sobinow. Die einzigartige gotische Architektur, die nicht mehr wiederholt überall in den Gebäuden der Stadt, zeichnet sich durch s...
Die Struktur des Neurons und seiner Funktionen морфофизиологические
ein Neuron als strukturelle und funktionelle Einheit des Nervensystems ist eine высокоспециализированную Zelle, die in der Lage zu generieren und zu leiten elektrische Impulse. Im Verlauf des Evolutionsprozesses Neuronen verloren ...
Sina Portnova: die Heldentat, die in die Geschichte einging
ein Kunststück, Stephan Портновой, kurzinhalt der wird in diesem Artikel beschrieben, nicht sehr breit berichtet im Internet. Informationen kurz und es wiederholt sich die ganze Zeit. Keine Quellen, die sich öffneten facettenreich...
Die Herkunft des Wortes "Bleistift". Der Wert des Gegenstandes in der Kunst
das Wort „Bleistift» für uns so vertraut, dass niemand dachte über seine Bedeutung und den Ursprung in der Russischen Sprache. Und inzwischen ist das Wort entstand in unserem großen und mächtigen Sprache mehrere Jahrhu...






















Kommentare (0)
Dieser Artikel wurde noch kein Kommentar abgegeben, sei der erste!